Carla Maria Franco Dias¹, Suelen Maria Parizotto Furlan¹ e Paula Andrea Navarro¹,²
- Departamento de Ginecologia e Obstetrícia da Faculdade de Medicina de Ribeirão Preto/USP
- Membro do Comitê de Infertilidade da SBRH e atual Presidente da SBRH
Introdução
As taxas de sucesso gestacional dos tratamentos de reprodução assistida ainda são baixas, mesmo em situações de bom prognóstico. Diante da falha de implantação embrionária, recaem questionamentos acerca dos fatores básicos que resultam na ocorrência da gestação: o embrião, o endométrio e a delicada interação entre estes dois.
Nesse contexto, pesquisas acerca do suporte de fase lútea para a transferência de embriões têm ganhado destaque. É durante a fase lútea que ocorre a ação da progesterona, hormônio essencial à implantação embrionária e à manutenção da gestação.
A literatura científica sobre o suporte da fase lútea exibe considerável heterogeneidade e falta de consenso acerca de um regime ideal. Dessa forma, esse boletim tem como objetivo revisar os principais aspectos relacionados ao suporte de fase lútea em diferentes preparos endometriais para transferência de embriões frescos e criopreservados.
Suporte de fase lútea para transferência de embriões a fresco após ciclos de estimulação ovariana controlada
Apesar de extremamente vantajosa, a estimulação ovariana controlada (EOC) perturba os mecanismos hormonais fisiológicos, levando a um perfil de progesterona endógena que difere daquele presente na fase lútea de ciclos naturais. Em ciclos de EOC, os níveis supra fisiológicos de esteroides, produzidos pelo número aumentado de corpos lúteos pós-punção, inibem diretamente a liberação de hormônio luteinizante (LH) via feedback negativo no eixo hipotálamo-hipófise, resultando em luteólise prematura, fase lútea encurtada e produção deficitária de progesterona endógena. Tal fenômeno é observado independentemente do protocolo de bloqueio hipofisário e do triggering escolhidos. Em ciclos com transferência de embriões frescos, portanto, torna-se necessário realizar o suporte de fase lútea com suplementação de progesterona exógena.
Até o momento, os estudos não demonstraram uma vantagem clara para nenhum regime específico de suporte de fase lútea e todas as vias de administração da progesterona parecem ser igualmente eficazes. A escolha da via e da formulação da progesterona é guiada pela preferência do paciente e do médico assistente. Em todo o mundo, a via preferida de administração é a via vaginal. Segundo a Sociedade Europeia de Reprodução Humana e Embriologia (ESHRE), é recomendada a administração de 200 mg (supositório de amido) a 600 mg (cápsula oleosa) de progesterona micronizada, divida em 2 a 3 aplicações diárias. O suporte de fase lútea também pode ser realizado com progesterona gel vaginal (90 mg/dia), progesterona intramuscular (50 mg/dia), progesterona subcutânea (25 mg/dia) e diidrogesterona (30 mg/dia).
De acordo com o último protocolo da ESHRE, publicado em 2019, a adição de estradiol durante o suporte de fase lútea não é recomendada, uma vez que não melhora as taxas de gestação e nascidos vivos ou a segurança em relação à síndrome de hiperestimulação ovariana (SHO). Em ciclos desencadeados com gonadotrofina coriônica humana (hCG), o hCG como suporte de fase lútea provavelmente não é recomendado, devido à não superioridade em relação ao suporte com progesterona exógena e ao maior risco de SHO.
Além disso, até o momento, o uso de agonista do receptor de hormônio liberador de gonadotrofina (aGnRH) associado ao suporte de fase lútea com progesterona pode ser feito apenas em contexto de pesquisa clínica. Apesar de dados promissores em relação ao aumento das taxas de gestação e nascidos vivos, os estudos com uso do aGnRH são de qualidade baixa, e os efeitos de longo prazo na saúde do recém-nascido não foram estudados. Da mesma forma, a adição de LH à progesterona para suporte da fase lútea pode ser usado apenas em contexto de pesquisa, visto a escassez de evidências que corroborem com o uso.
De acordo com a ESHRE, em ciclos de transferência de embrião fresco pós-EOC, o suporte de fase lútea com progesterona exógena pode ser iniciado a qualquer momento dentro de três dias após a captação oocitária e deve ser mantido até pelo menos o resultado do teste de gravidez (Figura 1). Em pacientes com gestação em curso, a maioria dos clínicos opta por manter a suplementação com progesterona até a mudança lútea-placentária, entre 8 e 12 semanas. Por sua vez, o início da suplementação da fase lútea antes da punção ovariana não é recomendado, devido à assincronia na janela de implantação embrionária, secundária à luteinização prematura do endométrio, com impacto negativo nas taxas de gestação.
Figura 1 – Suporte de fase lútea em ciclos estimulados
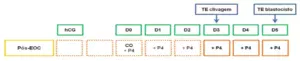
D: dias de fase lútea; CO: captação oocitária; EOC: estimulação ovariana controlada; P4: progesterona; TE: transferência embrionária. Os quadrados pontilhados sugerem suplementação de progesterona exógena opcional. Os quadrados com a linha cheia sugerem suplementação de progesterona exógena obrigatória.
Suporte de fase lútea para transferência de embriões criopreservados
Segundo a ESRHE, o número de ciclos de transferência de embriões criopreservados mais que triplicou nas últimas três décadas. No mesmo período, também houve aumento expressivo de ciclos de preparo endometrial para transferência de embriões oriundos de óvulos doados. Diversos são os motivos responsáveis por essa tendência atual, a citar: maior comodidade de preparos endometriais artificiais, maior segurança para pacientes com risco de SHO e casos de realização de diagnóstico pré-implantacional (PGT).
O preparo endometrial para transferência de embriões criopreservados pode ser realizado de diferentes maneiras: ciclo artificial, ciclo natural, ciclo natural induzido e ciclo natural modificado. Atualmente, não existem recomendações específicas para privilegiar um protocolo de preparo endometrial em detrimento de outro em termos de eficácia. Apesar disso, evidências recentes sugerem uma menor incidência de complicações obstétricas em ciclos naturais e naturais modificados quando comparadas a ciclos artificiais, incluindo o risco de hipertensão gestacional, pré-eclâmpsia, fetos grandes para a idade gestacional e abortamentos. A liberação de diversos fatores vasoativos pelo corpo lúteo – relaxina, citocinas, inibina A e FGF2, responsáveis pela adaptação cardiovascular e renal no início da gravidez, justifica os melhores desfechos em ciclos naturais. Todavia, há situações em que o preparo artificial do endométrio é preferido ou necessário, como, por exemplo, em pacientes com insuficiência ovariana prematura.
Preparo endometrial em ciclos artificiais
Ciclos artificias de preparo endometrial para transferência embrionária são amplamente difundidos na prática clínica, dada a sua maior flexibilidade e praticidade para a paciente e para a clínica de reprodução assistida. Em ciclos artificiais, são utilizados hormônios que mimetizam as fases do ciclo menstrual, sendo responsáveis por suprimir a atividade ovariana endógena, levando à ausência de um corpo lúteo.
A suplementação de estrogênio exógeno é a etapa inicial do preparo artificial. A estrogenioterapia por 7 a 14 dias, ou mais, simula a fase folicular, responsável pelo crescimento mitótico do endométrio. Na fase lútea de ciclos artificiais, a progesterona é habitualmente introduzida quando o endométrio apresenta características ideais na ultrassonografia, sugestivas de um endométrio funcional. Apesar de alguns estudos conflitantes, o aspecto trilaminar e a espessura acima de 7 mm são características consideradas sugestivas de um endométrio adequadamente proliferado.
A administração de progesterona exógena segue as mesmas recomendações de suplementação dos ciclos estimulados, mencionadas anteriormente, e deve ser feita em conjunto com a estrogenioterapia, sendo mantida até pelo menos a mudança lútea-placentária entre 8 semanas de gestação (Figura 2). Alguns estudos têm mostrado superioridade nos resultados gestacionais com o uso da progesterona intramuscular, isolada ou associada à progesterona vaginal. Entretanto, não está claro na literatura qual o regime ideal de suporte de fase lútea em ciclos artificiais. Além disso, a progesterona intramuscular apresenta alto custo, pouca disponibilidade no mercado, desconforto na aplicação e possibilidade de formação de abscesso local, limitando o seu amplo uso.
Figura 2 – Suporte de fase lútea em ciclos artificiais
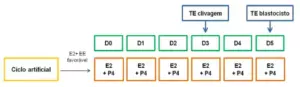
D: dias de fase lútea; E2: estrogênio; EE: espessura endometrial; P4: progesterona; TE: transferência embrionária.
Preparo endometrial em ciclos naturais e naturais modificados
Na transferência de embriões em ciclo natural, o preparo endometrial ocorre com produção endógena de hormônios. De forma mais fisiológica, é observada a presença de uma fase folicular, onde há seleção de um folículo dominante, com produção crescente de estrogênio endógeno e proliferação endometrial, seguida de ovulação, com formação de corpo lúteo, e uma fase lútea com secreção de progesterona endógena e transformação do endométrio, que adquire características secretoras, culminando com a janela de implantação embrionária.
Tais etapas podem ocorrer de forma totalmente natural – ciclo natural, principalmente em mulheres ovulatórias, ou de forma induzida – ciclo natural induzido, através do uso de indutores orais – como o letrozol ou o clomifeno, ou de gonadotrofinas, em mulheres anovulatórias. Ainda, no preparo endometrial com ciclos naturais, em casos selecionados, pode ser feito o desencadeamento da ovulação com o uso do hCG – ciclo natural modificado.
Preparos endometriais em ciclos naturais são mais imprevisíveis e menos flexíveis, sendo necessárias mais visitas à clínica de reprodução assistida para controle do ciclo. Notadamente, em ciclos naturais é importante avaliar o momento do pico de hormônio luteinizante (LH), responsável por precipitar a ovulação. O pico de LH pode ser documentado através da realização de exames urinários (fitas de LH) ou sanguíneos, com a dosagem quantitativa dos níveis séricos de LH. Não há consenso na literatura sobre qual o ponto de corte de LH sugestivo do início do pico de LH. De um modo geral, considera-se como pico de LH o aumento de pelo menos 180% do último valor medido, geralmente quando em níveis acima de 15 UI/L. Nesse momento, também é notável uma discreta elevação dos níveis séricos de progesterona e uma redução dos níveis de estrogênio circulantes.
Em ciclos naturais modificados, a administração de hCG pode ser considerada a partir do momento em que um folículo dominante atinge 15 mm de diâmetro, com endométrio adequado e após ser descartada a presença de um pico endógeno de LH. Em casos selecionados, com a finalidade de flexibilizar a data da transferência embrionária, pode ser considerado o desencadeamento da ovulação com folículos a partir de 13 mm, associado a endométrio adequado e níveis de estradiol compatíveis com um folículo dominante funcionante.
Após um pico espontâneo de LH, o início da ovulação varia de 24 a 56 horas, enquanto que, após a administração de hCG, a ovulação ocorre após 36 a 48 horas. A consequência dessa diferença se reflete em um início variável do aumento da progesterona e, portanto, também no momento da abertura da janela endometrial de implantação. Portanto, visando a sincronia entre embrião e endométrio, em um ciclo natural, deve-se considerar o início da fase lútea um dia após o pico do LH, e, em ciclos naturais modificados, dois dias após a aplicação do hCG, (Figura 3).
Ensaios clínicos randomizados não encontraram diferenças significativas entre os ciclos naturais e naturais modificados em termos de taxas de gestação clínica, de forma que o hCG pode ser usado com segurança em ciclos de transferência de embriões criopreservados. Um ponto positivo em relação ao uso do hCG é que ele permite uma melhor flexibilidade em relação à data de transferência embrionária, ao programar o desencadeamento da ovulação ao invés de aguardar a sua ocorrência espontânea.
Ciclos naturais induzidos, por sua vez, apresentam uma excelente opção de preparo natural em pacientes anovulatórias. Além disso, o uso de indutores da ovulação, orais ou gonadotrofinas, pode ocasionar um crescimento multifolicular, incrementando a secreção de estrogênio durante a fase folicular, sendo uma alternativa terapêutica em casos de endométrio fino, após tentativas de preparo endometrial com ciclo natural e ciclo artificial.
É válido lembrar que, em ciclos naturais, espontâneos, induzidos ou modificados, não é obrigatória a prescrição de progesterona exógena como parte do suporte de fase lútea, visto que há formação de um corpo lúteo funcionante. Entretando, estudos demonstraram que a suplementação de progesterona exógena em baixas doses diminuiu a taxa de abortamento e melhorou a taxa de nascidos vivos, quando comparada a ciclos naturais sem suplementação adicional. Entretanto, o diagnóstico de insuficiência lútea ainda é incerto para justificar tais achados.
Figura 3 – Suporte de fase lútea em ciclo natural/induzido e natural modificado

D: dias de fase lútea; EE: espessura endometrial; FD: folículo dominante; hCG: gonadotrofina coriônica humana; P4: progesterona; TE: transferência embrionária. Os quadrados pontilhados sugerem suplementação de progesterona exógena opcional.
Concentração sérica de progesterona e sucesso gestacional
Nos últimos anos, vários estudos foram publicados avaliando os níveis de progesterona durante a fase lútea e a sua correlação com o sucesso gestacional. Entretanto, a literatura ainda é bastante heterogênea e controversa acerca dessa temática.
Estudos que especificam a dosagem de progesterona sérica na fase lútea de ciclos de transferência de embrião a fresco após a EOC são escassos, heterogêneos e controversos. Dado o perfil anômalo da fase lútea após a punção ovariana de múltiplos folículos, os estudos disponíveis sugerem que a dosagem de progesterona durante a fase lútea inicial e média parece estar associada à resposta individual à EOC – reserva ovariana, número de folículos em crescimento, número de oócitos recuperados e idade feminina. Em ciclos estimulados, ainda não está claro se o sucesso gestacional está relacionado ao nível sérico de progesterona ou se a gestação seria um resultado de fatores de bom prognóstico gestacional, como a idade feminina mais jovem e a melhor qualidade embrionária, por exemplo.
A literatura sobre a progesterona em ciclos de preparo endometrial para transferência de embriões criopreservados, por outro lado, é mais ampla. A grande maioria dos estudos disponíveis foram realizados com preparo endometrial em ciclos artificiais e, portanto, com fonte de progesterona completamente exógena. Todavia, estes estudos são de baixa qualidade e relatam diferentes pontos de corte de progesterona sérica relacionados a melhores desfechos gestacionais. Apesar disso, a maior parte dos estudos concluiu uniformemente que baixos níveis de progesterona estão associados a piores taxas de gestação.
Uma revisão sistemática e meta-análise, publicada por Melo et al., 2021, incluindo 21 estudos de coorte que avaliaram a dosagem de progesterona na fase lútea, concluiu que níveis séricos de progesterona abaixo de 10 ng/mL estão associados a menores taxas de gestação e nascidos vivos e maior risco de abortamento em mulheres submetidas a preparo endometrial para transferência de embriões criopreservados. No entanto, esta mesma revisão não conseguiu concluir se um nível mais alto de progesterona estava associado a melhores desfechos de tratamento, devido à heterogeneidade significativa entre os estudos, escassez de dados prospectivos e intervalos de confiança amplos em torno de estimativas de efeito combinadas.
Alguns estudos de intervenção, com suplementação adicional de progesterona exógena, demonstraram efeito benéfico nas taxas de gestação em mulheres com progesterona “baixa”. Outros estudos, no entanto, não obtiveram a mesma diferença, de forma que, não está claro se a suplementação de progesterona extra é capaz de promover um resgate endometrial. Em contrapartida, alguns estudos sugerem que o excesso de progesterona pode ser tão prejudicial aos resultados do tratamento quanto a progesterona “baixa”. Portanto, ainda não está claro se os níveis séricos de progesterona podem constituir um fator preditor confiável do sucesso gestacional em ciclos de transferência de embriões criopreservados.
Ciclos naturais, naturais induzidos e modificados ainda precisam ser mais bem avaliados em relação à dosagem de progesterona durante a fase lútea. Os estudos disponíveis ainda são muito escassos e devem levar em consideração a produção de progesterona endógena, que é secretada de forma cíclica e pulsátil, o que torna a metodologia das pesquisas mais desafiadora e com risco de vieses. Além disso, fatores individuais, relacionados à secreção, absorção, biodisponibilidade e metabolização da progesterona, precisam ser mais bem elucidados.
Conclusões
Apesar das pesquisas recentes e avanços tecnológicos, ainda existem nuances incompreendidas acerca da fase lútea. Ciclos naturais de preparo endometrial parecem estar relacionados a menores complicações obstétricas. Todavia, ainda não há consenso sobre a melhor estratégia de suporte de fase lútea associado a melhores taxas de sucesso gestacional.
Dados sobre a relevância da concentração sérica de progesterona durante a fase lútea ainda são limitados. Deve-se ter cautela ao interpretar concentrações notavelmente baixas de progesterona em ciclos de transferência embrionária. Ainda não há consenso sobre o benefício da suplementação de progesterona extra como forma de resgate endometrial, bem como não é definido um ponto de corte que indique uma política de cancelamento de transferência a fresco e congelamento total dos embriões.
Ensaios clínicos randomizados mais robustos são necessários para avaliar a eficácia de um suporte lúteo individualizado com base nas concentrações séricas de progesterona.
Referências bibliográficas
Alonso-Mayo C, Kohls G, Santos-Ribeiro S, Soares SR, Garcia-Velasco JA. Modified natural cycle allows a window of 7 days for frozen embryo transfer planning. Reprod Biomed Online. 2024 Jul;49(1):103774. doi: 10.1016/j.rbmo.2023.103774. Epub 2023 Dec 17. PMID: 38609793.
Devine K, Richter KS, Jahandideh S, Widra EA, McKeeby JL. Intramuscular progesterone optimizes live birth from programmed frozen embryo transfer: a randomized clinical trial. Fertil Steril. 2021 Sep;116(3):633-643. doi: 10.1016/j.fertnstert.2021.04.013. Epub 2021 May 13. PMID: 33992421.
Dias CMF, Furlan SMP, Ferriani RA, Navarro PAAS. Serum progesterone measurement on the day of fresh embryo transfer and its correlation with pregnancy success rates: A prospective analysis. Clinics (Sao Paulo). 2024 Oct 9;79:100511. doi: 10.1016/j.clinsp.2024.100511. PMID: 39388739; PMCID: PMC11736334.
European IVF Monitoring Consortium (EIM) for the European Society of Human Reproduction and Embryology (ESHRE); Smeenk J, Wyns C, De Geyter C, Kupka M, Bergh C, Cuevas Saiz I, De Neubourg D, Rezabek K, Tandler-Schneider A, Rugescu I, Goossens V. ART in Europe, 2019: results generated from European registries by ESHRE†. Hum Reprod. 2023 Dec 4;38(12):2321-2338. doi: 10.1093/humrep/dead197. PMID: 37847771; PMCID: PMC10694409.
Fatemi HM, Polyzos NP, van Vaerenbergh I, Bourgain C, Blockeel C, Alsbjerg B, Papanikolaou EG, Humaidan P. Early luteal phase endocrine profile is affected by the mode of triggering final oocyte maturation and the luteal phase support used in recombinant follicle-stimulating hormone-gonadotropin-releasing hormone antagonist in vitro fertilization cycles. Fertil Steril. 2013 Sep;100(3):742-7. doi: 10.1016/j.fertnstert.2013.05.028. Epub 2013 Jun 24. PMID: 23806846.
Garg A, Zielinska AP, Yeung AC, Abdelmalak R, Chen R, Hossain A, Israni A, Nelson SM, Babwah AV, Dhillo WS, Abbara A. Luteal phase support in assisted reproductive technology. Nat Rev Endocrinol. 2024 Mar;20(3):149-167. doi: 10.1038/s41574-023-00921-5. Epub 2023 Dec 18. PMID: 38110672.
Kim CH, Lee YJ, Lee KH, Kwon SK, Kim SH, Chae HD, Kang BM. The effect of luteal phase progesterone supplementation on natural frozen-thawed embryo transfer cycles. Obstet Gynecol Sci. 2014 Jul;57(4):291-6. doi: 10.5468/ogs.2014.57.4.291. Epub 2014 Jul 15. PMID: 25105102; PMCID: PMC4124090.
Melo P, Chung Y, Pickering O, Price MJ, Fishel S, Khairy M, Kingsland C, Lowe P, Petsas G, Rajkhowa M, Sephton V, Tozer A, Wood S, Labarta E, Wilcox M, Devall A, Gallos I, Coomarasamy A. Serum luteal phase progesterone in women undergoing frozen embryo transfer in assisted conception: a systematic review and meta-analysis. Fertil Steril. 2021 Dec;116(6):1534-1556. doi: 10.1016/j.fertnstert.2021.07.002. Epub 2021 Aug 10. PMID: 34384594.
Munné S, Kaplan B, Frattarelli JL, Child T, Nakhuda G, Shamma FN, Silverberg K, Kalista T, Handyside AH, Katz-Jaffe M, Wells D, Gordon T, Stock-Myer S, Willman S; STAR Study Group. Preimplantation genetic testing for aneuploidy versus morphology as selection criteria for single frozen-thawed embryo transfer in good-prognosis patients: a multicenter randomized clinical trial. Fertil Steril. 2019 Dec;112(6):1071-1079.e7. doi: 10.1016/j.fertnstert.2019.07.1346. Epub 2019 Sep 21. PMID: 31551155.
Roelens C, Blockeel C. Impact of different endometrial preparation protocols before frozen embryo transfer on pregnancy outcomes: a review. Fertil Steril. 2022 Nov;118(5):820-827. doi: 10.1016/j.fertnstert.2022.09.003. PMID: 36273850.
Roque M, Nuto Nóbrega B, Valle M, Sampaio M, Geber S, Haahr T, Humaidan P, Esteves SC. Freeze-all strategy in IVF/ICSI cycles: an update on clinical utility. Panminerva Med. 2019 Mar;61(1):52-57. doi: 10.23736/S0031-0808.18.03492-4. Epub 2018 Jun 28. PMID: 29962183.
World Health Organization. Infertility prevalence estimates, 1990–2021. World Health Organization; 2023.